・原子が電気を帯びたもの
・プラスの電気を帯びたものは陽イオン
・マイナスの電気を帯びたものは陰イオン
ここは、とある県にある学校です。
2人の生徒が、休み時間に早弁をしながら楽しそうにお喋りしています。


さっきの授業って、何の話だった?
ちょっと聞き逃したわ

おまえ、最初からずっと爆睡だっただろう

いや、そんなことはない。ラスト1分は起きてた。原子の構造とかイオンとか言ってたけど…何だそれ?

しょうがないな、説明してやろうか? 次の時間はテストだからな

助かるー
鈴木は、弁当の焼飯の中から、箸で人参と緑豆をそれぞれ2個ずつつまみ出し、弁当箱の蓋の上にくっつけて置きました。そして、米も2粒だけ、その周りに置きました。
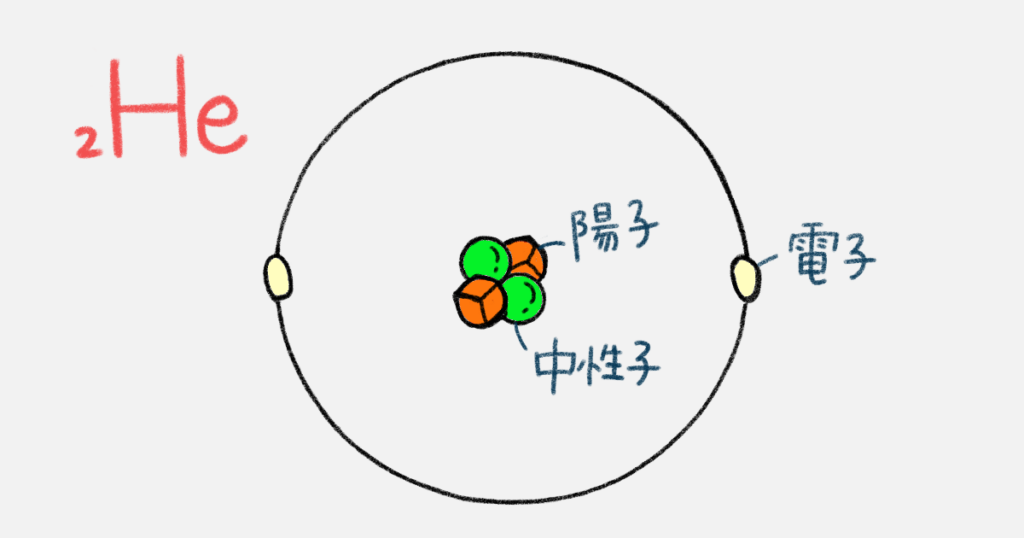

これがヘリウム原子だ。人参が陽子、緑豆が中性子、米粒が電子

全部2個ずつ?

そう。原子の種類は陽子の数で決まる。ヘリウムは原子番号2番で陽子の数は2個、ついでに電子の数も2個だ

ふーん、原子番号と陽子の数と電子の数は同じ…。どの元素でも?

同じだ。例えば…、
水素の原子番号は1で、陽子と電子の数はそれぞれ1個だ。
ナトリウムの原子番号は11で、陽子と電子の数はそれぞれ11個だ

中性子も同じ数じゃないのか?

同じじゃない場合もある。とりあえず今からの話で大事なのは、陽子はプラスの電気、中性子は中性、電子はマイナスの電気をもっているということだ。陽子と電子の数は同じだから、原子全体では電気的に中性なんだ

ヘリウムだったら、プラスの陽子2個とマイナスの電子2個でプラマイゼロってこと?

あたり。でも、陽子や中性子と違って、電子は外側にあるだろう。だから、原子は電子を失ったり受け取ったりすることがあるんだよ。
ほら、リチウム原子だとこんな感じ
鈴木は、原子の構造図に新たな材料を足しました。
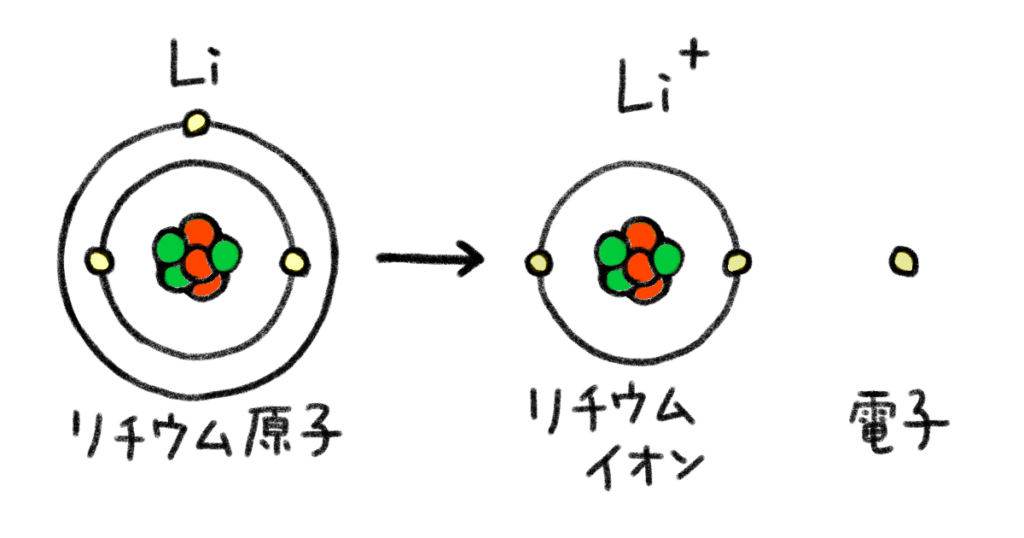

リチウムは原子番号3番で、もともとの陽子の数は3個。電子の数も3個。だけど、電子を1個失ってイオンになる

プラスの陽子が3個、マイナスの電子が2個になったから、原子全体でプラスの電気が1個多くなったのか

そう、電子を失うと、原子全体でプラスの電気を帯びて陽イオンになるんだ。じゃあ今度は…
鈴木は、さらに原子の構造図に新たな材料を足しました。
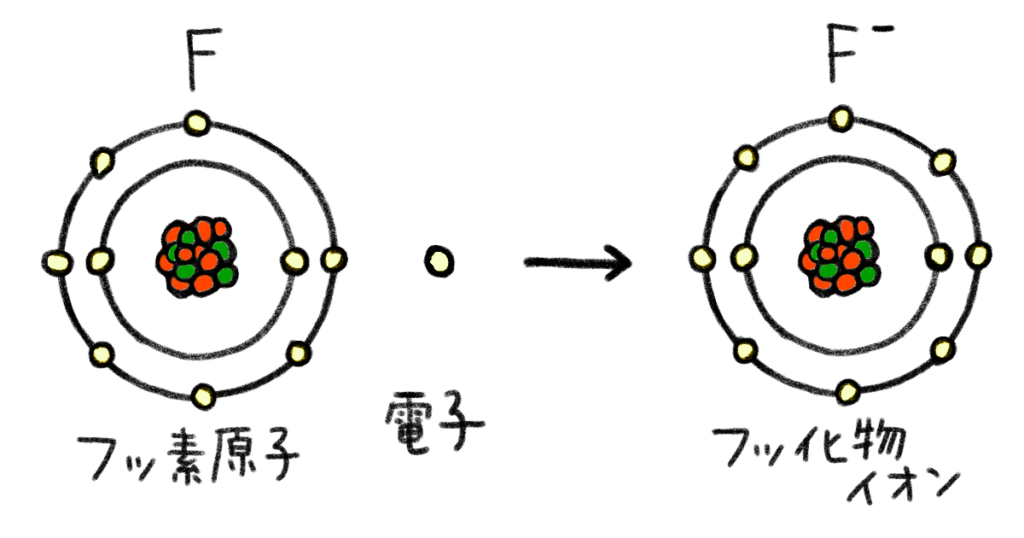

フッ素は原子番号9番で、もともとの陽子の数は9個。電子の数も9個。だけど、電子を1個もらってイオンになる

プラスの陽子が9個、マイナスの電子が10個になったから、原子全体でマイナスの電気が1個多くなったのか

その通り。電子をもらうと、原子全体でマイナスの電気を帯びて陰イオンになるんだ

なるほど、電子を失うとプラスの電気を帯びた陽イオンになって、電子をもらうとマイナスの電気を帯びた陰イオンになるってことだな!簡単じゃん!

おまえたち、もう授業が始まってるのにいつまで弁当を広げてるんだ!
イオンには2種類ある。プラスの電気を帯びたものは陽イオン、マイナスの電気を帯びたものは陰イオン。どっちになるのかは、原子が電子を失うか、それとも電子を貰うかによって決まるよ。


